社説(8月28日)認知症新薬承認へ 安全確保の具体策示せ
製薬大手のエーザイと米バイオジェンが共同開発したアルツハイマー病治療薬「レカネマブ」の製造販売承認を、厚生労働省の専門部会が了承した。近く承認される見通しだ。年内にも保険適用される可能性がある。病気の原因物質を取り除いて進行を緩やかにすることを狙った画期的な新薬で、患者や家族、医療関係者らの間で期待が高まっている。
ただ、臨床試験(治験)の結果では、その効果はあまり大きくないとされ、副作用も明らかになっている。投与できる対象が軽度の患者やその予備軍である軽度認知障害(MCI)の人に限られること、薬価が高額になることなど実用化に当たっては課題が多い。政府はこうした課題の解決に取り組み、新薬を安全に使用できるようにするための具体策を示さなければならない。
アルツハイマー病はアミロイドベータというタンパク質が脳内に蓄積し、神経細胞を傷つけて発症すると推測されている。現在使われている薬は脳の神経伝達物質の量を増やすなどして一時的に症状を改善する働きがあるが、レカネマブはアミロイドベータに結合して除去することで病気の進行を抑制する。
治験では、薬を投与しない患者に比べ症状が悪化するのを27%抑制したとの結果が出た。一方で脳の微小出血やむくみなどの副作用が確認され、海外では血栓を予防・溶解する抗血栓薬を同時使用した患者の死亡例も報告された。こうした効果やリスクに関する情報を患者や家族にしっかりと提供し、薬を使用するか適切に判断できるようにしなくてはならない。
また、副作用の出やすい遺伝子型があることが分かっており、先行して1月に承認した米国は投与前に遺伝子検査をすべきだとした。日本でも承認に当たっては検査を必須とすべきだろう。
レカネマブはアルツハイマー病以外の認知症や症状が進んだ患者には投与できない。対象の患者は投薬前に陽電子放射断層撮影(PET)や脳脊髄検査でアミロイドベータが脳に蓄積していることを確認し、投薬中は副作用を確認するため頭部の磁気共鳴画像装置(MRI)検査を行う。これらに対応できる医療体制の整備充実も求められる。
レカネマブの薬価は、米国では標準で1人当たり年2万6500ドル(約380万円)だという。国内については、厚労相の諮問機関である中央社会保険医療協議会が年内に決めるが、医療財政が逼迫[ひっぱく]して医療費削減が求められる日本でレカネマブによる治療がどう行われるべきか、これから十分に議論しなければならない。
シニア・介護・終活・相続の記事一覧
-
大自在(4月23日)ウオーキング


-
高齢者身元保証事業で指針 トラブル防止で契約・説明書要請へ 政府、5月にも決定


-
認知症理解へステッカー 沼津商高生と清水町が制作 地域で支援


-
静岡人インタビュー「この人」 マジックを通じた認知症予防に取り組む マギー塁さん(掛川市)


-
介護や防災対応 セニアカー提案 スズキ、大阪で出展

-
「健康づくりサポーター」日本旅行静岡支店に登録証 いきいきフォーラム21

-
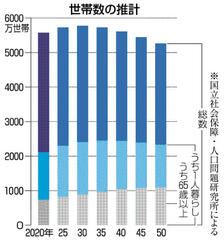
高齢単身世帯 50年に20% 厚労省将来推計 見守りや介護課題に

-
生命保険契約照会制度 契約有無 家族らが確認【ライフセミナー】

-
【聞きたい】免許返納後も移動の喜びを 電動アシスト四輪自転車発売 望月誠/セリオ社長

-
【はりきり人生】地域から依頼、作る喜び 商店街で木工活動/京極敬二さん(富士宮市)

-
科学未来館「老いパーク」 衰え体験 広がる共感 歩行、聴力… メカニズム紹介

-
【もの知りキーワード】高齢社会の「2025年問題」 5人に1人が75歳以上に 働き手不足、社会保障費増

-
安心の終活へ 静岡市が優良事業者認証 第1号に社福法人まごころ

-
特別養護老人ホーム「こもれび」で「花まつり」 釈迦像に甘茶かけ祝う 静岡市清水区

-
裾野市の特別養護老人ホーム 開設事業者を募集 5月31日締め切り

-
「なかよし」移転オープン 磐田の老健施設 需要増に対応

-
島田市、40歳以上の補聴器購入に補助

-
能登地震3カ月 広域避難に一定の成果(立木茂雄/同志社大教授)

-
シャワーだけで毛が抜ける【アラ還2人のがん奮闘記⑦】

-
春満喫 桜の下でリハビリ 静岡市葵区の高齢者介護施設

-
マイナ活用 行政手続き簡略化 袋井市が電子申請窓口 浅羽支所で検証 市長が体験「簡単で安心」

-
コーヒーが認知症リスクに影響

-
遺贈の円滑化へ協定 島田掛川信金と袋井市

-
止まらぬ値上げ 家計逆風の春 トラック運転手、医師は残業規制 保険料上げ、コロナワクチン自己負担も 4月 変わる暮らし

-
思い出胸に頑張って 放課後等デイサービス 卒業生3人が門出 静岡市葵区

-
高齢者福祉・介護 充実へ3カ年計画 裾野市

-
清水町マンション内、高齢者の居場所 食事会や花見開催 生活にそよ風を

-
地域課題解決へ産学連携 静岡英和学院大が参加 都内で会見

-
75歳医療保険料 4月上げ 応能負担、540万人対象

-
要介護度改善の実践を評価 静岡市、優秀事業所を表彰

-
清水区4団体へ助成金 リョービ社会貢献基金 静岡市

-
東京 終活スナック開業 お酒片手に「死」語ろう 棺おけに入る体験も

-
神奈川の特養ホーム 要介護者に寄り添う犬猫 施設長「人生の楽しみ守る」

-
裾野市役所に「頼りになる窓口」 ワンストップで待ち時間減へ 業務効率化図る

-
認知症ソフトボール、富士宮で全国大会 工藤公康さん視察、声援送る

-
外国人材の訪問介護、拡大へ 特定技能解禁、24年度にも

-
市介護保険条例の改正案など可決 御殿場市議会閉会

-
静岡県職員人事異動 班長級4月1日付

-
コラム窓辺 介護は突然に(水野裕央/日本銀行静岡支店長)

-
静岡県職員人事異動 課長級以上 4月1日付 部長級 局長級 課長級

-
介護報酬のコロナ特例廃止 接種の送迎、4月から

-
まちづくり戦略課や産業振興課など新設 西伊豆町

-
浜松市人事異動(4月1日付)退職

-
生体・生活データで認知症選別 大分大など 有害タンパク質の蓄積予測

-
地域課題解決へ11分野で連携協定 三島市と明治安田生命

-
静岡市人事異動(4月1日付)局長級・局次長級・参与級・課長級・採用・清水病院医療職・局次長級・参与級・課長級・採用・消防局・参与級・課長級

-
【はりきり人生】マンドリンサークル主宰 野沢講一さん(浜松市天竜区) 理想の演奏の形を追求

-
安眠のこつ 眠れなくても焦らないで 生活習慣の見直し有効

-
【高齢者の相談室】定年後、新しい仕事を希望 コーディネーターが支援(静岡県労働雇用政策課)

-
相続登記 4月から義務化、新制度を周知 静岡県司法書士会

-
浜松の障害者施設 運営ピンチ 築40年で移転、クラウドファンディング募る

-
バトン いずれは地元へ DWAT 出口戦略に苦慮 復興見据えた調整力 鍵に【つなぐ 災害福祉 東日本大震災13年㊦】

-
【もの知りキーワード】認知症基本法 来年に推計700万人へ 支援事業の育成急務

-
DWAT誕生、広がる志 静岡でも創設、そして能登へ【つなぐ災害福祉 東日本大震災13年㊥】

-
新聞配達員 高齢者の事故防ぐ 静岡・清水署、2人に感謝状

-
1800人の避難所、細る福祉「専門職を早期に」 岩手の窮状、派遣チームの教訓に【つなぐ災害福祉 東日本大震災13年㊤】

-
認知症の情報交換 カフェで気軽に 清水町で当事者ら

-
入れ墨入浴者入場 河津町議会で否決 温泉の運営条例改正

-
家族介護者 頑張り認め 休憩を 静岡でストレスケア講座

-
静岡県立大生 介護の魅力発信 職場体験報告会 利用者との対話重視

-
医療、福祉、司法 専門職が相談会 9日、静岡と伊豆

-
脳と腸の密接な関係【未来は腸内細菌とともに⑥】

-
睡眠薬の使用やめたい まずは別の種類に変更を【診察室】

-
高齢者のがん医療説明 長泉、5年ぶり対面「会議」

-
4日から代表、一般質問 藤枝市議会

-
高所得者の支払い、施設利用料上げ… 介護保険制度改正で負担増 地域格差加速 懸念も

-
【はりきり人生】「すわま」 作りを指導 太田悦子さん(湖西市) 郷土菓子、次代に伝える

-
介護・福祉用品のタイカ(静岡市創業) 清水病院に100万円 91年から寄付続ける

-
看護・介護体験談を募集 オレンジクロス(東京都)

-
手術時連絡先 やっと提出(藍田紗らら/ライター)【アラ還 2人のがん奮闘記②】

-
更年期障害、7割が自覚症状

-
社説(2月28日)成年後見制度 利用者本位の改善急げ

-
認知症新薬の治療開始 浜松・聖隷三方原病院 女性2人に点滴投与 静岡県内4施設目

-
認知症高齢者の徘徊、デジタル機器で捜索 熱海で県内初の実証実験

-
29日から総括質問 静岡市議会

-
介護や家事支援 発足40年で交流 NPOがイベント 静岡市葵区

-
線路迷い込んだ高齢男性を保護 原さんに感謝状 湖西署

-
地域福祉に役立てて 文化祭の収益寄付 函南・田方農高生徒会

-
認知症理解促進へ 活動確認 西伊豆、キャラバン・メイト連絡会

-
健康長寿の延伸など重点 袋井市しあわせ計画、市長に答申

-
「おひとり様」の助け合い(藍田紗らら/ライター)【アラ還 2人のがん奮闘記①】

-
「我が家の終活」 静岡県が3月にセミナー 静岡、沼津、浜松で

-
共生型福祉施設普及へセミナー 29日、静岡

-
島田市独自の介護予防体操、しまトレ100カ所目 川根温泉で記念イベント

-
外国人材に「選ばれる県」へ サポートセンター開設 受け入れ環境整備 膨らむ介護ニーズに対応【静岡県24年度予算案】

-
成年後見 見直しへ 柔軟運用目指し期間制も 法相諮問表明

-
ED薬 認知症に効果か

-
社説(2月12日)介護報酬改定 訪問サービスなぜ減額

-
望む終末期の医療 家族と話し合って 浜松市天竜区で講演会

-
茶況(2月8日)認知症カフェで茶の入れ方教室 菊川市茶業協会

-
映画通じ認知症への理解深める 清水町で上映会

-
要配慮者搬送 DMAT続ける 能登派遣静岡県チーム 活動長期化 「地域に受け皿つくる」

-
詐欺被害防止貢献 2人に署長感謝状 富士署、警備会社社員

-
冬場のお風呂の入り方 ヒートショックに気をつけて【高齢者の相談室】

-
静岡人インタビュー「この人」 高校生有志団体「US(アス)」の代表 川畠慎之介さん(静岡市駿河区)

-
医療ケア児の支援充実へ 障害福祉職員ベア2%以上に 厚労省

-
外国人介護職員1000人超 静岡県調査、雇用事業所も最多423カ所

-
「フレイル」予防へ講演 シニア世代100人参加 静岡市駿河区

-
磐田市11件誤送付 介護保険料の納付済額通知書

-
御殿場市高齢者福祉計画を策定 委員会が市長に報告

-
進む高齢化 裾野市がスーパーなどと支援チーム 認知症の人に優しい店作り 従業員が見守り、声かけ

-
歌、踊り生き生きと 静岡市駿河、葵区のシニアクラブ連合会が発表会

-
静岡市、九州大と連携 市民データ活用で健康施策立案へ 疾患傾向と生活習慣解析

-
定年後の再就職 何から始める ジョブステーション利用を【就活の相談室】

-
不登校でも「学校」に行かせるべき?⑧ 読者の意見【賛否万論】

-
手品を使って認知症予防 島田市 マギー塁さんが講座 マギー司郎さんもサプライズ登場

-
介護職員確保へベア2%以上に 厚労省24年度報酬改定方針

-
2次避難、高齢者の心身不調懸念 環境変化、死の危険も【能登地震】

-
高齢者自殺予防へ心構え学ぶ 「ゲートキーパー」養成研修 静岡市葵区

-
24年度介護保険料 40~64歳は月6276円 当初の3倍超

-
高齢者虐待増 22年度482件 介護職員からは最多 静岡県まとめ

-
社説(1月16日日)介護保険負担拡大 持続性高める議論必要

-
若年性認知症 考えよう 2月4日、清水町で映画上映

-
介護サービスを知りたい 利用者に寄り添う優良事業所も【高齢者の相談室】

-
介護計画作成にAI活用 ケアマネ業務効率化へ 静岡県、効果検証

-
在宅医療の質向上へ 監視システムで急変“予知” 磐田の安間院長、開発進める

-
認知症患者ケア 手作りマフ寄贈 静岡市清水区の笑和会

-
認知症基本法施行へ 1月1日 患者や家族の意見反映

-
浜松商高女子団員 応援歌やショー披露 浜松市中区の高齢者施設

-
特養待機者5000人割る 静岡県内4月時点、3年連続減

-
優良介護事業所 静岡県、5施設を表彰

-
磐田市老人ク連 16万5000円寄付 福祉施設、市社協に

-
裾野市 高齢者福祉支援拡充へ 来年度から3カ年計画策定

-
障害者との共生 実現への道は? 静岡市葵区でフォーラム

-
クリスマスイベント満喫 天竜高福祉科生と高齢者交流

-
骨粗しょう症 服薬間隔 長いもの多く【もっと広がる クスリの世界】

-
大自在(12月22日)新聞感想文コンクール

-
厚労省の健康寿命アワード 静岡県内3団体が受賞

-
18日から一般質問 川根本町議会

-
介護ロボット 最新技術体験 静岡でフォーラム

-
ハンドベル 音色にうっとり 沼津特支で演奏会

-
送迎バスの安全装置設置率70% 24年3月末完了へ 静岡県発表

-
認知症新薬 保険適用 20日から販売 薬価年298万円

-
「良い介護」テーマ 静岡でセミナー 19日

-
衛生用品を寄贈 国際ソロプチミスト焼津

-
介護施設利用者の作品100点 裾野 19日まで「芸術祭」

-
不登校でも「学校」に行かせるべき?③ 関係者インタビュー【賛否万論】

-
認知症早期発見 沼津でイベント 太陽生命支社

-
「お達者度」1位は介護予防事業成果 菊川市議会一般質問

-
在宅、時差出勤 選択可に 厚労省案 育児、介護 働き方支援

-
介護の技術を審査 最優秀に望月さん 静岡でコンテスト

-
特殊詐欺被害防止 JA職員に感謝状 富士署

-
住民らが貼り絵や演奏 掛川・大渕地区でフェスタ

-
焼津市議会一般質問に10氏登壇 12月5、6日

-
要介護者らの避難 セニアカーを活用 浜松市南区で訓練

-
介護予防に「民」の発想 24年度、静岡市が委託事業 成果に応じ「報酬」変動

-
女性のセカンドキャリア考える 「経済自立」に高い関心 静岡市葵区でセミナー【70歳の壁 シニア雇用を考える】

-
島田市議会 1日から一般質問

-
遺産相続テーマにセミナー 浜松市北区

-
ノルディック・ウオーク体験会、累計50回達成 駿府城公園近くの休憩施設拠点

-
広い園内セニアカーで 浜名湖花博プレイベントで体験会

-
裾野市が12月に新たな窓口開設 死亡、相続手続き1カ所で

-
脳機能低下、食道がん、人とトラブル、認知症… 飲酒に初指針 「アルコール量」重要、年代別リスク周知

-
認知症高齢者の徘徊対策 見守りシステム登録を【西部 記者コラム 風紋】

-
認知症不明者捜索 流れ実践 声かけや家族へ連絡 焼津で訓練

-
健康長寿者64人を表彰 掛川市 末永くお元気で

-
⚽エスパルス下部組織出身5人 三島に交流カフェ開設へ 「地元への感謝、形に」資金募る

-
浜松で在宅ケア懇談会 地域で認知症予防を

-
福祉計画案など伊東市が諮問 市介護保険協議会に

-
少量でも発症O157に注意を 西伊豆・特養食中毒2人死亡 一般家庭もリスク

-
モンゴル県知事と川勝氏が会談 介護、経済分野で交流深化へ

-
孤独・孤立対策へ官民組織、静岡県が設立 コロナで深刻化、支援機関連携促進

-
リハビリ病院に運転シミュレーター 脳卒中患者ら可否判断の材料に 高齢者の検査、訓練利用も 藤枝

-
大きなイモ掘れた 沼津・東熊堂自治会

-
研究展示や実験体験 静大浜松キャンパス 市民に公開

-
地域で支える介護 市民に啓発 JR静岡駅で県協議会など

-
介護分野支援へ 静岡県が本腰 モンゴルで面接+ICT活用 人材獲得、定着に向け業務改善

-
「健幸」へ難聴と認知症の関係解説 聖隷袋井市民病院の医師 登壇

-
静岡県と浜松市、障害児通所給付費を過大支給 会計検査院が指摘

-
浜松・水窪放火1カ月 自殺の“前兆”事件食い止められたか 専門家「検証必要」【ニュースBOX】

-
ピクセルアート 子ども熱中 沼津・放課後等デイサービス

-
エルタックス 公金納付にも 26年開始 目指す

-
認知症研究、年度内着手 政府方針 神経回路再生など前倒し

-
ゲームや運動で認知症予防 聖隷クリストファー大生が講座 浜松市天竜区

-
介護給付費 初の3000億円超 21年度 静岡県内 制度開始から3.7倍に

-
補正予算案など7案件可決同意 川根本町議会閉会

-
創業志す人らセミナーで交流 川根本町

-
犬と触れ合い 充実の時間 御前崎の高齢者施設

-
28施設の合同作品展 天竜厚生会、10月29日まで

-
全国介護技能コンテストで優秀賞 白扇閣(清水区)の望月さん

-
介護保険改定や人手不足考える 10月28日、静岡市でシンポ

-
高齢者グループ 文化作品100点展示 浜松市浜北区

-
介護職の現状ややりがい紹介 静岡市葵区で復職応援セミナー

-
社協の高齢者サロン送迎開始 免許返納者に対応、地域活性化へ 沼津・浮島地区の社会福祉法人

-
菊川市、介護保険料徴収ミス 計64件 起算日変更怠る

-
最新サポートカー並ぶ 高齢運転者支援へ静岡県自動車学校がイベント

-
その人らしく生きるケア方法を考える 沼津で医療関係者研修

-
静岡・建穂地区の高齢者 運動会満喫し交流

-
マジック通じ認知症予防 島田 マギー塁さんが講座

-
判断能力不十分になった時が不安 将来に備え「任意後見制度」利用を【高齢者の相談室】

-
時論(10月8日)老いには大きな意味がある

-
93歳大村さん 静岡で集大成の絵画展 色鉛筆で緻密

-
施設利用者ら パン食い競争奮闘 伊豆の国 地域と交流楽しむ

-
鹿児島国体 7日開幕 本県選手団を発表

-
清水町の高齢者対象事業 地域とつながり健康に【東部 記者コラム 湧水】

-
15日に地域交流イベント 御前崎のデイサービス

-
お年寄り 地域で見守り 西伊豆・大浜地区住民がチーム 認知症支援体制拡充へ

-
マスコットは「カッキー」 清水町社協 設立50周年講演会 お笑い「レギュラー」の講演も

-
高井さんの100歳祝福 伊豆の国市長訪問

-
創業セミナー 参加者を募集 川根本町

-
介護保険自己負担 松崎町、設定ミス

-
子ども一時預かり 検索システム導入 10月から 浜松市議会

-
障害者雇用へ理解深める 浜松で企業セミナー

-
福井大軽音部OB演奏会 音楽で旧交温め生き生き 4年ぶり全国から集結 10月1日 浜松

-
認知症理解 まちの本屋から始めよう 清水町連携 特設ブース設置

-
「あなたの年齢では雇えない」 年齢不問とあるのに...有名無実の求人票、差別では? 静岡県内で不満絶えず

-
訪問型の介護や看護 サービス内容学ぶ 焼津市医師会が勉強会

-
静岡県内9法人に福祉車両寄付 鈴木道雄記念財団

-
パン取り競争 よーいドン! 浜松市北区で障害者スポーツ大会

-
社説(9月25日)介護離職対策 職場の理解欠かせない

-
通所児童のSDGs工作展 袋井 30日まで

-
100歳祝い肖像画プレゼント 浜松・浜北区の画家山田さん

-
潜在的な福祉課題、災害で露見 台風15号から1年 被災者支援で初めて把握

-
虚偽記録で報酬不正受給か 障害者施設大手「恵」 元社員ら証言、会社は否定

-
終活支援に優良認証制度 静岡市が本年度内 事業者審査し質担保へ

-
シニア世代 自由に語り合おう 10月5日、静岡で懇談会

-
障害児の性教育 「情報繰り返し伝えて」 静岡市葵区で講座 家庭でできること紹介

-
酢やシソで減塩のススメ 清水町が食育研修

-
犬と触れ合い高齢者ら笑顔 湖西で施設訪問

-
ピアニスト東さん 音楽活動の思い紹介 浜松市天竜区・光が丘中で講演

-
サービス利用者にプロの演奏お届け 静岡の社会福祉法人「楽寿会」

-
半身まひ 心境を絵本に 「目に見えない痛み」赤裸々 浜松の小杉さん制作

-
裾野の100歳長寿を祝福 市長が戸別訪問

-
リハビリで粘土制作 岡本さん夫妻(清水区)が作品展 静岡市葵区

-
パラスポーツ通じ福祉の理解深める 浜松・舞阪小4年生

-
長寿祝い敬老会 浜松・山香地区 地元有志が演芸披露

-
医療的ケア児ママ 当事者の思い表現 沼津で山本さん写真展

-
社説(9月19日)訪問介護員の不足 若い人材確保が急務だ

-
特殊詐欺被害防げ 実際の音声で学ぶ 静岡南署が防犯講話

-
ボランティア「里いもの会」 福祉施設で歌や踊り披露 湖西

-
桜葉スイーツに舌鼓 松崎で敬老の日イベント

-
湖西の山田さん、もうすぐ100歳 川勝知事らが祝福 敬老の日に訪問

-
静岡県内精鋭集う「松崎卓球」 65歳以上の部で全国優勝

-
75歳の市民2300人 藤枝市がお祝い

-
新しい敬老会 輪投げやカラオケ、学生と交流 静岡・駿河区

-
各地で敬老会 掛川・出野さん100歳 市長、賞状と記念品

-
敬老会 歌と歓談楽しむ 浜松市北区・平山自治会

-
各地で敬老会 高齢者、喜び合う 浜松市中区・住吉自治会

-
菊川市長ら長寿を祝う 敬老会に高齢者331人

-
障害者雇用を促進 事業所や個人表彰 静岡で大会

-
きょうから一般質問 牧之原市議会

-
101歳 野中さんの長寿お祝い 函南町長が花束

-
認知症について学びたい 各地で講座開催、啓発イベント【高齢者の相談室】

-
園児が高齢者に贈り物 「敬老の日」健康長寿祝う 静岡市葵区

-
認知症患者支援へ条例 静岡県内初 藤枝市が制定方針

-
終活講座 9月21日開催 浜松・天竜区佐久間

-
76歳鈴木さん(伊豆の国)世界1位 金メダル23個目 ウエートリフティング マスターズ

-
19日から一般質問 焼津市議会、13氏登壇

-
島田にeスポーツ専用室 地域活性化、介護予防 市長設置方針

-
藤枝市は大規模大会 サッカーのまち100年 eスポーツ活用 市長誘致方針

-
認知症の早期発見、治療へ 初期集中チームが支援 長泉町議会 町部長答弁

-
フードバンクふじのくに、回収食品を仕分け「今後もご協力を」

-
認知症の母 映画に 信友監督が講演会 10月16日、沼津

-
「アベノマスク」ハンカチに デイサービスなどに寄贈 三ケ日赤十字奉仕団

-
障害者差別直結の相談増加51件 静岡県内22年度、合理的配慮 事業者側も悩み

-
認知症当事者の集い「本人ミーティング」広がる 藤枝市など 体験談冊子を作成

-
牧之原置き去り事件1年 バス安全装置設置53% 障害児施設に遅れ 静岡県まとめ

-
一般質問に19氏 9月7日から藤枝市議会

-
アルツハイマー月間に合わせ 認知症関連書籍並ぶ 伊豆の国中央図書館

-
「わ」の力で障害越え 9月10日に慈善コンサート 浜松・北区

-
親世帯の資産管理などでセミナー 遠州信用金庫、浜松で9月16日

-
静岡県内 5市町で統廃合 背景に採用難 訪問介護事業所

-
訪問介護220カ所休廃止 全国社協 5年で13%減

-
認知症 寸劇で学ぶ 静岡市葵区

-
保険会社の介護保険 給付要件や内容を確認【ライフセミナー】

-
支援利用者の新規就労祝う 静岡・明光会が激励会

-
ケアマネ資質向上へ評価表 5段階で判定 静岡県独自 サービス底上げ

-
JAふじ伊豆2支店、特殊詐欺防止に貢献 警察署から感謝状

-
行政はカードの暗証番号聞きません! 劇で特殊詐欺「ご用心」 浜松の介護施設

-
障害者アート展示の輪 静岡県の貸し出し事業 企業の活用増

-
「おいしい!プロジェクト」10年ぶり活動再開 嚥下障害予防 焼津の有志が力

-
アルツハイマー病新薬 「レカネマブ」承認へ 厚労省

-
車椅子利用者も海を満喫 静岡・三保でユニバーサルビーチ

-
障害者らの孤立 刑務所実態に学ぶ 富士宮で9月3日

-
独居高齢者の災害対策考える 浜松・天竜でセミナー

-
静岡県、介護人材確保へ覚書 モンゴル国立医科大と 9月、現地で合同面接会

-
静岡県の授産製品企業認定制度 購入・発注 年30万円超「SDGSの理念実現」

-
介護施設BCP策定 相談会で理解深める 西伊豆

-
12施設で使えるチケット配布 焼津市 65歳以上の市民対象

-
夏休み ちょこっとボランティア 湖西の中学生 高齢者と触れ合う

-
ダウン症少年画家 大村さん個展 個性豊かな力作並ぶ 5日まで 浜松市北区

-
介護保険料算定 市民147人分誤り 掛川市

-
湖西拠点 移動スーパー導入 遠鉄ストア 浜松・西区も巡る

-
健康マージャン 練習熱心に 9月沼津市制100周年記念大会へ

-
花火 楽しく安全に 富士宮で教室

-
豊かな高齢期へ介護予防のポイント解説 静岡で講演

-
天竜杉ベンチ寄贈 聖隷クリストファー大生制作 福祉施設などへ

-
三谷さん100歳 仲間ら祝福 浜松・北区の介護施設

-
車いすで海水浴楽しんで ユニバーサルビーチ 下田で体験会

-
大自在(7月27日)森村誠一さん逝く

-
あいさつや地名を手話で 伊豆市、小学生対象に講座 25年デフリンピック開催向けて

-
「終活」のポイントを解説 浜松市天竜区で講座

-
富士宮の藤田さん 手縫い雑巾5000枚寄贈 「小さな親切」運動実行章

-
地域の夏祭り4年ぶり 盆踊りや模擬店も 浜松・北区

-
IT業界に障害者の力 プログラミング技術指導 浜松の支援事業所が実績 県内での採用促進へ意欲

-
特養施設内に日本語学校 静岡市で開校式典 社会福祉法人駿府葵会

-
静岡人インタビュー「この人」 家族を世話する子どもの支援団体「ヤングケアラー協会」理事 高垣内文也さん(浜松市中区)

-
静岡県児童養護施設 協議会に120万円 北里コーポレーション

-
シニア就職相談会 高い満足度、混雑課題 ハローワーク静岡で開始1年

-
手品で100歳をお祝い 静岡の高齢者施設 劇団招き誕生会

-
給付金詐欺罪で放課後デイ理事長に実刑判決 地裁浜松支部

-
問われる 施設の在り方 国連や内閣府の委員を務めた全盲の社会学者石川准さん 【アフターコロナへ 私の視点⑭】

-
認知症対応学びサポーターへ 浜松市天竜区で養成講座

-
高齢者の労災リスク最小限に ヒヤリ・ハット共有、改善 体調管理で事故防ぐ【70歳の壁 シニア雇用を考える】

-
高齢者・介護事業 3カ年計画策定へ 裾野市

-
「介護の未来ナビゲーター」に福祉事業所若手職員委嘱 静岡県事業

-
認知症の予防方法 健康づくり秘訣は 松崎で講演会

-
介護現場視点で自治体に提言へ 連盟県支部設立総会

-
ろう者の市職員が手話伝授 焼津南小で出前授業 ペアで自己紹介も

-
里親家庭の交流支援 静岡・清水区のNPO 寄付金でランチ提供

-
不整脈の原因や対処法解説 静岡で公開講座

-
eスポーツ 高齢者の刺激に リハビリに活用、太鼓ゲームで効果検証 静岡・葵区の施設

-
台風15号被災者をおもてなし 日帰りサロンで「旅行気分」 静岡・清水区

-
〝お試し期間〟あってもいい、自分が否定されている思い... シニア雇用 年齢で判断されるのはあり?④ キュレーター/読者の意見【賛否万論】

-
生きがいある余生守る 高齢者の身元保証や葬送支援をする 石川真奈美さん【アフターコロナへ 私の視点⑪】

-
マジックで認知症啓発 マギー司郎さんの弟子塁さん 焼津の高校生らと交流グループ立ち上げ

-
モンゴルで介護人材確保へ 9月現地面接控え 静岡県が概要など説明

-
古紙を活用 紙すき体験 デイサービスでSDGs 牧之原

-
高齢者に優しく声かけ 裾野・向田小児童 認知症学ぶ

-
殉職看護師の志継ぐ 静岡市立病院で空襲犠牲者慰霊式 誓いのキャンドル

-
特支生徒、桜葉収穫に汗 担い手確保へ農福連携 松崎

-
子ども食堂に最大5万円 静岡県、物価高騰受け支援金給付

-
災害ボランティア 支援スタッフ養成 7月、静岡で講座

-
福祉の就職相談 7月、静岡県内3会場で

-
福祉の職場体験 参加者を募集 来年1月末まで

-
避難所運営 ゲームで訓練 御前崎市民110人参加

-
「想定外」少ない年金 仕事探す定年退職者 生活維持へ余儀なく【70歳の壁 シニア雇用を考える】

-
症状と向き合う俳優・谷田歩さん 完璧求める姿 葛藤も【吃音と歩む 思い伝えたい④】

-
「小さな親切」運動 焼津のきょうだいに実行章 医療用に髪提供

-
静岡県立総合病院に100万円寄付 フジ物産

-
食事しながら介護の悩み共有 島田市がマクドナルドで認知症家族会

-
息子と「二人三脚」の経験生かして 保護者同士交流図る【吃音と歩む 思い伝えたい③】

-
言語聴覚士目指し大学で専攻 同じ境遇 支える側に【吃音と歩む 思い伝えたい②】

-
日大三島、知徳高生 認知症学ぶ 店内対応を模擬体験 団体の啓発動画協力へ

-
夢の接客、深めた自信「注文に時間がかかるカフェ」【吃音と歩む 思い伝えたい①】

-
障害者雇用のつなぎ役 アイエスエフネット(東京都)/渡辺幸義社長【キーパーソン】

-
有償の高齢者外出支援始める 藤枝・西益津の住民団体 無償から移行

-
着服の職員懲戒解雇へ 小山町社協 事務受託団体などに損害

-
島田市議会 12日から一般質問

-
40歳から補聴器購入に補助 現役世代から認知症を予防 掛川市

-
焼津の農園 「農福連携」作業ねぎらい 施設利用者招きイチゴ狩り

-
在宅療養支援に特化 御殿場に診療所開所

-
夏も元気に! 熱中症対策 中高年「はつらつ講座」

-
福産品購入企業を認定 障害者の工賃向上後押し 静岡県が制度、入札優遇へ

-
静岡県内障害者就職3000件超 静岡労働局、22年度 コロナ前上回る

-
卓球白熱、気持ち上向き 静岡ジェードが教室 認知症ケア施設

-
問われる当事者に寄り添う姿勢/どうする少子化 国と地方ができることとは⑥キュレーター・読者の意見【賛否万論】

-
障害者アート一堂に 静岡県がポータルサイト開設 貸し出し利用後押し

-
ケアプラン作成、AIが支援 西山病院グループ(浜松市西区)【DX最前線】

-
「終末期対話」認知度低く ACP「知らない」63% 22年度地域医療県民調査

-
「高齢者介護学ぶ」 研修員が市長訪問 メキシコ→伊豆の国

-
放課後デイ施設 磐田で開所式

-
落語家・林家久蔵さんが記念講演 下田の生涯学習講座開講

-
介護保険料巡り 静岡市徴収ミス システムの変更怠る

-
カフェで本音話しやすく 開放的な会場に変更 焼津「認知症本人ミーティング」

-
遺族の手続きワンストップで「おくやみコーナー」沼津市、6月開設

-
大自在(5月26日)物忘れ

-
記者コラム「清流」 迫られる地域づくり

-
高齢世帯の生活支援へ地域住民組織が発足 浜松・笠井地区

-
7県の介護施設職員、福祉スキル高め合う 浜松で老健大会始まる

-
放課後デイ詐欺罪 検察懲役3年求刑 地裁浜松支部公判

-
社説(5月24日)政府の少子化対策 受益と負担 徹底議論を

-
高齢者福祉、介護 計画策定委が会合 御殿場市

-
静岡県民の歯科受診半数以下 糖尿病患者、低い傾向 静岡県と社会健康医学大学院大が分析、施策に反映

-
認知症予防テーマに講座 新潟県人会 静岡市葵区で6月4日

-
「静岡いのちの電話」相談員を募集 6月1日から

-
共生拠点施設お披露目 静岡・明光会

-
アフガンに関心を 静岡でカレーズの会理事長が講演 静岡県ボラ協総会

-
「SOS、確実に支援へ」 静岡県社会福祉士会 設立30周年で式典

-
独居高齢者、地域で見守る 認知症やうつ病特徴学ぶ「ご近所サポーター」養成講座 浜松市天竜区佐久間町

-
熱海から静岡へ「被災者と共に」支援のバトン 相談員、経験つなぐ

-
子どもの「居場所」夢育む 御殿場のNPO、施設開所

-
障害への理解促進 表彰候補者を募集 22日まで、静岡県

-
⚽サッカーは障害の垣根なし J3沼津、子ども対象に大会 放課後デイサービス勤務の浜選手企画

-
貸し切り天浜列車で交流 ダウン症児保護者ら 掛川の団体

-
認知症高齢者の接し方学ぶ 御前崎・浜岡中

-
介護美容「福祉ネイル」 沼津・誠恵高生体験 千葉の大学職員が講座 認知症予防に効果

-
静岡市葵区に地域共生拠点 明光会 6月開所へ

-
介護+看護 晩年穏やかに 看護師・カウンセラー浅原さん 静岡に“みとりの家”開設

-
やさしい日本語40種、LINEスタンプに 静岡県が作成 外国人への配慮を啓発

-
浜名湖エデンの園 開園50周年祝う

-
高齢者が音楽で生き生き交流 熱海に地域サロン

-
「道路損傷通報」に最高賞 職員提案の業務改善策 焼津市が優秀事例表彰

-
医師の仕事、医療の現状学ぶ 浜松聖星高 浜医大と連携講座

-
浜松市社協と静岡大情報学部 地域共生へ連携協定 ICT助言、人材育成も

-
心の病支えたい ピアスタッフ活動広がり 静岡県内病院、福祉事業所

-
文書記載ミスなど16件 22年度 静岡市監査委員が指摘

-
生活介護や放課後等デイサービス 障害者福祉施設が完成 磐田

-
要介護度改善で表彰 静岡市の5事業所

-
友人の介護疲れが心配 地域包括支援センターに相談を【高齢者の相談室】

-
認知症高齢者の便秘改善 排便習慣確立、促進姿勢で効果 聖隷クリストファー大准教授 世界初の実証試験

-
静岡人インタビュー「この人」 賀茂地域の課題解決に取り組む弁護士 三森祐二郎さん(河津町)

-
富士山噴火避難、備え見直し 病院や学校、静岡県内230施設が計画作成へ

-
障害者在宅介護 緊急対応体制充実求める【統一地方選 地域課題を考える 記者からの提言 番外編】

-
障害者対象の就労相談 12日から賀茂5町

-
介護人材不足「解決道筋を」 事業関係者 若手確保や待遇改善要望

-
「感染管理」認定看護師 教育課程スタート 静岡県看護協会 1期生9人開講式

-
介護の職場環境整えて 福祉/浜松市政への注文 看護師・中村泉さん(浜北区)

-
静岡人インタビュー「この人」 日本顧問介護士協会理事長 石間洋美さん

-
健康マージャン 愛好家ら楽しむ 沼津で交流大会

-
赤い羽根共同募金 交付先に通知書 静岡で説明会

-
袋井市と静岡社会健康医学大学院大 地域の健康 共同で研究

-
介護施設BCP策定支援へ研修 静岡県内430人受講

-
eスポーツ活用を浜松市に政策提言 商議所青年部

-
補助犬の活動を本に 静岡・駿河区のNPO 県内小学校、図書館に寄贈へ

-
触れ合い、主体性大切に ボランティアで学び 支援必要な子と高校生 浜松

-
ヤングケアラー同士交流 浜松市中区でイベント「共感多く、気持ち楽に」

-
生活困窮者の支援 静岡・葵区で公開研究会 県労働者福祉基金協

-
磋牙司さん相撲人生回顧 故郷の三島で講演会

-
浜松市人事異動(4月1日付)部長級・次長級・課長級・区課長級・中区役所・東区役所・西区役所・南区役所・北区役所・浜北区役所・天竜区役所・兼務・退職

-
三島市人事 DX推進へ新体制 対象者281人

-
高齢者施設で手品 富士の望月さんに実行章 小さな親切静岡県本部

-
静岡市人事異動(4月1日付) 局長級・局次長級・参与級・課長級・採用・清水病院医療職・局次長級・参与級・課長級・消防局・参与級・課長級・退職

-
介護者交流会で心の負担を軽減 小山町

-
「孫に会いたい」一心 リハビリ重ね見守り隊に 沼津の79歳男性

-
健康情報カレンダーに 島田市が作製 あすから全戸配布

-
医療介護の製品企画検討 現場の声共有し議論 袋井で産学官金

-
高齢者支援アプリ三ケ日版が完成 福祉施設やバス停など検索 静大

-
介護人材 モンゴルで発掘へ 23年度に合同面接会 静岡県、人手不足の解消狙い

-
静岡県内最大規模 通所リハビリ施設完成 浜松市西区の西山病院

-
就労支援施設の作業体験 知的障害ある子ら挑戦 静岡市中央福祉センター

-
小学生「いのちつなぐ手紙」朗読 自殺対策強化月間で催し 浜松市精神保健福祉センター

-
障害者の農業参画シンポジウム開催 浜松で16日

-
森町 高齢者の支援体制充実【未来につなぐ 遠州7市町23年度予算案⑦】

-
タオル580枚 社協に寄贈 田方労福協

-
J3アスルクラロ沼津 木札型年パス製作 地元福祉施設とコラボ

-
「ベッドから3歩」高齢者住環境講座 長泉・ファルマバレーセンター

-
車いすで乗り降り UDタクシー試乗 静岡市駿河区のNPO

-
認知症当事者 関わり方は 清水町で語り合い

-
放課後デイ理事長 別施設の詐欺認める 地裁浜松支部公判

-
静岡福祉大と富士市が協定 地域発展、人材育成で協力

-
「証人尋問求めず」 弁護側が書面提出 元天竜市長再審請求

-
地域の安全、防災など連携 函南町、あいおいニッセイと協定

-
高齢者の自立へ 住環境支援 2月28日に沼津でセミナー

-
「認知症ケアにプラモ講座」 静岡市長 関係者と可能性探る

-
「磐田学園」新園舎完成 家庭的療育へ居場所確保

-
ひとり親 新児童にランドセルを寄贈 静岡駿府ライオンズクラブ

-
静岡・駿河区のスギセキ 子ども食堂に寄付

-
飲酒ひき逃げ 起訴内容認める 地裁浜松支部初公判

-
記者コラム「清流」 命救った生徒の勇気

-
カップ麺や菓子 食品60キロを寄付 小さな親切静岡県本部

-
施設にマスクケース 静岡・賤機北小児童が寄贈 手作り品収益で購入

-
障害者団体の陳情不採択 福祉交流センターの無料利用継続 浜松市に厳しい意見も

-
介護サービスの研修センター開設 遠州鉄道

-
就労支援の20年振り返る 静岡、サポーターら記念式典

-
介護、認知症予防にeスポーツ 島田市、新年度から事業開始

-
社会貢献、思いを形に 遺贈先に日赤紹介 スルガ銀行が協定

-
静岡人インタビュー「この人」 富士ばやしの普及に努める富士市民踊会会長 伊藤芳子さん

-
浜松市福祉交流センター無料利用継続、市に要望 2障害者団体

-
介護職マッチング支援相談会 掛川市で2月4日開催

-
静岡人インタビュー「この人」 賀茂地域で住民の健康長寿研究に取り組む 田原康玄さん(静岡市駿河区)

-
行方不明女性を保護 浜松西署 宮部さん(浜松市立高)に感謝状

-
社会福祉施設参加のまちづくり学ぶ 静岡市駿河区で研修会

-
社説(1月23日)介護保険の負担増 判断先送りは不信招く

-
「成年後見制度」利用促進へ 2月から磐田市内22カ所で説明会

-
認知症サポーター 裾野市が2月24日に養成講座 受講無料

-
特養ホーム希望者減 5462人 4月時点 静岡県調査「ニーズは高い状態」

-
磐田市 介護保険資格者証誤交付

-
発達障害の「理解と配慮」学ぼう 静岡県自閉症協会 20日から、静岡・富士・浜松で

-
高齢者のごみ出し支援 富士宮の協議体が市に提言 地域社会再構築へ一歩【解説・主張しずおか】

-
サロン活動に優良表彰 浜松・中区西地区社協、国から

-
楽しい食事、エプロンから 食べこぼし防止で負担軽減 島田「オビヤコ」が施設に寄贈

-
福祉活動充実へ 2団体に助成金 静岡市社協

-
介護ロボ技術紹介 静岡でフォーラム

-
ゲームで共生社会体験 障害児の母が製作 理解深め、楽しさ知って

-
高齢者買い物 支え合う 独居者送迎、下田で実証実験 交通手段や生きがい創出

-
ヤングケアラーの支援加速 静岡県がピアサポート導入 経験交え寄り添う

-
かるたで学ぶ認知症 焼津でお披露目 市民「イラストかわいい」

-
介護助手にシニアの力 静岡県内施設、働きやすく業務細分化の動き 体力必要な仕事は専門職に/朝と夕方2時間ずつ勤務

-
認知症と車の運転テーマ 当事者ら、思いや体験語る 富士宮市がフォーラム

-
障害者対象の無料就労相談 賀茂地区で11日から

-
跳ぶ楽しさを障害児に 競技と育児の経験生かしトランポリン教室

-
スマホの使い方、高齢者が指南 袋井・森で講師育成に着手、同世代に分かりやすく

-
サロン千福が丘(裾野) 優秀賞受賞を報告 静岡県コミュニティー活動賞

-
放課後デイサービス利用者 スポーツで交流 裾野で催し

-
「避難入院」体制整備を ALS患者ら 災害時の長期停電を不安視

-
脳や心の病を診断、治療法創造へ 光医学研究所開設 浜松医大検討

-
不適切行為 会見前日まで家族に報告せず 南伊豆の精神科病院 「目に見えるけがない」「法には触れず」

-
奨励賞受賞喜び報告 焼津高2年の鈴木さん 社会福祉活動取り組み評価

-
公民館に出張しマイナ申請補助 高齢者向けに巡回 清水町

-
放課後デイ運営理事長 別施設でも不正受給、詐欺罪で追起訴 静岡地検浜松支部

-
門松、毎年3センチずつ高く 菊川・青葉台コミュニティセンターに設置

-
不正受給で指定取り消し 浜松の通所事業所3施設

-
妻の4度目の命日に報告 台風、過酷な介護を直撃 息子と「綱渡りの日々」【障害者と生きる 第4章 災害㊤】

-
民生・児童委員 新退任者に委嘱状、感謝状 浜松市

-
高齢者の虐待 静岡県内428件 介護施設は過去最多 2021年度

-
住宅関連会社×障害者施設 「住福連携」推進へ 受注作業ひと目、カタログ作成

-
筒状ニット「マフ」の中に手 認知症患者の心穏やかに 治療、ケア時の身体拘束軽減も

-
運転ボランティア養成 西伊豆町社協、高齢者支援へ講座

-
点字カレンダー 304部製作 藤枝順心高 特支学校などに寄贈へ

-
クリスマスプレゼント 東部の福祉施設に 4市町の14菓子店

-
ABCが500万円 静岡県社協に寄付 車両購入に活用

-
医療センターに車いす6台寄贈 掛川の村岡財団

-
ひとり親家庭 支援へ 650人分食料用意 静岡県労福協など

-
コンセプトは「老いと向き合う」 焼津・橋本組が新住宅ブランド 宿泊可能なモデルハウス開設

-
記者コラム「清流」 人生の回顧録 明るい色に

-
認知症、かるたで学ぶ 市民作品、46句厳選 焼津市が制作

-
高齢者生活支援へ 西伊豆町社協がボランティア養成講座

-
農福連携 赤カブ初収穫 静岡の事業所、生産者減少のオクシズに光





 いい茶
いい茶